仕事で役立つ人気ビジネスアプリおすすめ!
[PR]
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。
東大、赤痢菌などに感染された細胞が自殺する仕組みを解明
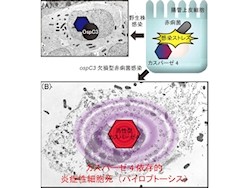
東京大学は5月16日、「赤痢菌」、「サルモネラ」、「腸管病原性大腸菌」などが消化器官の「粘膜上皮細胞」へ感染すると、生体防御反応としてタンパク質「カスパーゼ4」に依存する「アポトーシス(細胞死)」が誘導されることを発見したと発表した。
成果は、東大医科学研究所 附属感染症国際研究センター 感染制御系 細菌学分野の小林泰良学術支援専門職員、同・三室仁美准教授、笹川千尋東大名誉教授らの研究チームによるもの。研究の詳細な内容は、5月15日付けで「Cell Host & Microbe」に掲載された。
粘膜上皮細胞は、個体の外来病原微生物に対する第一線の防御壁として、外来病原体を排除するメカニズムを持つ。例えば「腸管上皮細胞」は、ひとたび微生物が侵入して感染すると、免疫応答による危険信号を発して炎症反応を起こしたり、感染細胞に細胞死を誘導したりすることで、異物である病原微生物を排除する仕組みだ。
しかし、赤痢菌などの高度病原細菌は粘膜上皮細胞内に侵入して感染すると、感染細胞の細胞死を抑制することが知られている。赤痢菌は、「エフェクター」と呼ばれる病原因子を多数持ち、注射器のような「III型分泌装置」によってエフェクターを細胞内に注入して感染することが知られていたが、細胞死を抑制するエフェクター分子は同定されていなかった。
そこで研究チームは今回、細胞死を抑制する赤痢菌エフェクターを探索するために、複数のエフェクターの遺伝子欠損変異赤痢菌株が感染した上皮細胞の細胞傷害性で研究を実施。その結果、「ospC3欠損変異株(ΔospC3株)」の感染細胞では、感染後2-4時間という短時間で著しく細胞が傷害されることが見出されたのである。
ΔospC3株感染細胞を電子顕微鏡で観察すると、細胞膜が傷害された像が観察された。また、ΔospC3株が感染した上皮細胞では、核の断片化と、「炎症性サイトカイン」(さまざまな細胞から分泌され、細胞同士の情報伝達に関わり、特定の細胞の働きに作用するなど、多様な生理活性を持つタンパク質で、炎症性サイトカインは炎症を強める働きを持つ)の分泌が見られた一方で、感染細胞の傷害性は、細胞死を司るカスパーゼ酵素群の内のカスパーゼ1/4/5の活性を特異的に阻害する阻害剤で抑制されたことから、ΔospC3株感染細胞では「パイロプトーシス」と呼ばれる細胞死が誘導されることが明らかになった。
なおカスパーゼは「プロテアーゼ」と呼ばれるタンパク質の一群であり、多細胞生物の細胞は感染やがんで個体全体へ障害が及ぶ時に個体を生かすために自らは「アポトーシス(プログラムされた細胞死)」を選択するのだが、それを制御しているとされる。しかし、実は未だ不明な点も多い。またパイロプトーシスは、炎症性サイトカインの分泌を伴うアポトーシスの1種だ。主に血球系細胞で報告され、カスパーゼ1の活性化に依存しているが、近年ではマウスのカスパーゼ11の関与が報告されている(マウスでは、カスパーゼ4の代わりにカスパーゼ11を持っている)。
そしてモルモットを用いた動物感染モデル実験が行われ、その結果、ΔospC3株が感染すると腸管上皮細胞に細胞死が起きて出血を伴う組織破壊が見られると共に、腸管粘膜組織中の赤痢菌数が減少することが明らかになった。従って、赤痢菌OspC3エフェクターは感染細胞の細胞死を抑制することで、赤痢菌が感染増殖する細胞の足場を確保して、感染を拡大することが示唆されたというわけだ。
次にOspC3の標的因子を同定するため、パイロプトーシスに関与する可能性があるタンパク質との結合に関する検討が行われた。すると、OspC3はカスパーゼ4と特異的に結合することが明らかになったのである。また、カスパーゼ4のノックダウン細胞では、パイロプトーシスが著しく抑制されることも判明。これまでの報告では、パイロプトーシスはカスパーゼ1を介することが報告されていたことから、今回の研究で見出された細胞死は新規メカニズムによる細胞死であることが示唆された。
細胞内のカスパーゼ4は限定分解により、「CARD」、「p19」、「p10」の3つに切断され、p19-p10の4量体が成熟体としてタンパク質分解活性を持つようになると考えられている。またOspC3は、カスパーゼ4のp19と特異的に結合することも確認済みだ。
また細胞に赤痢菌が感染するとカスパーゼ4は限定分解されるが、一方で、成熟型カスパーゼ4に精製OspC3タンパク質を添加すると、カスパーゼ4のタンパク質分解活性が阻害されることが確かめられた。さらに、OspC3はp19-p10結合を阻害することも見出されたのである。従ってOspC3は、カスパーゼ4のp19と結合することで、p19-p10の多量体化によるカスパーゼ4の成熟を阻害することが示唆された。
さらにOspC3部分欠失変異体を用いて、活性に重要なアミノ酸領域の検討が行われたところ、OspC3のC末端約30アミノ酸領域がカスパーゼ4との結合に必須であることが判明。また立体構造予測から、OspC3配列中に存在するカスパーゼ4の「基質推定配列(LSTDN)」が、カスパーゼ4のタンパク質分解活性ポケットに作用することが予測された。
カスパーゼ4のp19-p10を細胞に強制発現させることで誘導される細胞死は、OspC3の細胞内導入で抑制されたが、上述のカスパーゼ4結合配列とLSTDN配列のアミノ酸を変異させたOspC3の導入ではまったく抑制されなかったのである。従って、OspC3は2つの領域によりカスパーゼ4の活性を阻害することが示唆された形だ。
さらに、赤痢菌以外の腸管病原性細菌であるサルモネラと腸管病原性大腸菌の感染細胞においても、カスパーゼ4に依存したパイロプトーシス細胞死が観察されたことから、カスパーゼ4が引き起こす細胞死は、宿主細胞による病原体排除のための共通した機構であることが示唆されたのである。
今回の研究から、粘膜感染病原細菌の感染を排除するためのカスパーゼ4を介した細胞死分子機構が明らかになった。カスパーゼ4は敗血症に関与することが注目され始めた分子であることから、今回の研究は、カスパーゼ4が関与する細菌感染症や敗血症に対する特異的阻害薬を開発する足がかりとなることが期待されると、研究チームはコメントしている。
(A):エフェクターOspC3がカスパーゼ4の活性を阻害することで、細胞死が抑制される結果、菌のの感染・増殖が促される。(B):OspC3が欠損した赤痢菌はカスパーゼ4の活性を阻害できず、細胞死によって菌増殖の場所を失うと共に炎症が惹起される
