仕事で役立つ人気ビジネスアプリおすすめ!
[PR]
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。
理研ら、「Aβ43」をアルツハイマーの強力な病態促進因子であることを発見
理化学研究所(理研)を中心とする研究グループは、アルツハイマー病の原因物質と考えられているアミロイドβペプチド(Aβ)のうち、これまで見過ごされていた亜種「Aβ43」が、アルツハイマー病の強力な病態促進因子であることを明らかにした。同成果は、理研脳科学総合研究センター 神経蛋白制御研究チームの西道隆臣チームリーダー、斉藤貴志研究員らと、同志社大学の井原康夫教授、舟本聡准教授、滋賀医科大学の西村正樹教授、Antwerp大学のChrstine V. Broeckhoven教授らとの共同研究によるもので、英国科学雑誌「Nature Neuroscience」(オンライン版)に掲載された。
アルツハイマー病は、老人性認知症の中で患者が最も多い疾患で、脳内に老人斑(アミロイド斑)といわれる過剰なタンパク質の「シミ」が沈着することが病理学的な特徴の1つ。このアミロイド斑の主成分がAβであることが近年判明し、Aβの過剰な蓄積がアルツハイマー病の発症の原因と考えられるようになり、Aβの産生を促進する遺伝子変異が、家族性アルツハイマー病を引き起こしているため、アルツハイマー病の治療には、Aβを脳内から除去することが重要だと考えられてきた。
Aβには、アミノ酸の長さが異なるAβ40とAβ42の存在が古くから知られており、これまでこの2種類のAβを中心にアルツハイマー病研究が進められてきたが、Aβ40やAβ42だけを標的とした治療では、アルツハイマー病の進行を食い止めることが難しかったものの、2005年頃の研究から、Aβ40やAβ42以外にもアミノ酸の長さが異なるAβ亜種が存在することが徐々に知られるようになり、従来の研究を見直す機運が高まっていた。
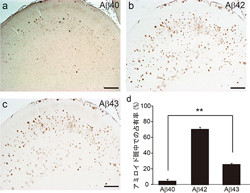
今回、研究グループは、孤発性(非遺伝性)アルツハイマー病患者4人のAβ種の存在率を免疫組織化学的に解析し、アルツハイマー病患者の脳内で、Aβ43がAβ40よりも高頻度で存在していることを発見した。
図1 アルツハイマー病患者の脳切片における各Aβ43の存在比率。アルツハイマー病患者の脳内では、Aβ42が70%、Aβ43が28%存在した
画像解析による定量の結果、アルツハイマー病患者の脳内では、Aβ42 が70%、Aβ43が28%と両者がそのほとんどを占めており、これまでAβ43が見過ごされていたことが判明した。
そのため研究グループでは、アルツハイマー病発症に対するAβ43の役割を明らかにすることを目指し、既存の抗体からAβ43に特異的な抗体を選定し、Aβ43を特異的に検出するELISAシステムを構築した。
図2 Aβ43に特異的な抗体の選定とELISAシステム。左が各種Aβを様々な量で電気泳動を行いウェスタンブロット法で抗体の特異性を確認したもので、結果として、選定した特異的抗体はAβ43と特異的に結合した。右がこの抗体を用いてELISAシステムを構築した結果。Aβ40やAβ42にはまったく反応せず、Aβ43のみを特異的に検出した
同システムを用いて、野生型マウスとアルツハイマー病モデルマウスとして既に知られているアミロイドβ前駆体タンパク(APP)トランスジェニックマウスそれぞれの脳内のAβ43濃度の定量を行った結果、野生型マウスでも、APPトランスジェニックマウスでも、加齢に伴って脳内のAβ43の濃度が増加したことが確認された。
図3 マウス脳内におけるAβ43量の加齢依存的増加。左が野生型マウス。若年齢マウス(3カ月後)の脳内では検出しなかったAβ43が、老年齢マウス(24カ月後)の脳内では有意に検出された。一方の右がAPPトランスジェニックマウス。加齢に伴って脳内のAβ43の濃度が増加しており、これは、アミロイド斑が出現するのに先行して始まり、Aβ43の増加が引き金となりアミロイド斑が形成されたと考えられる
このことから、ヒトやマウスの種を問わず、生まれながらに一定量産生されているAβ40やAβ42とは異なり、Aβ43は加齢性変化を示すAβ亜種であることが判明したほか、APPトランスジェニックマウス脳内でのAβ43の濃度の増加は、その脳内でアミロイド斑が出現する前から増加し始めていることを発見。これは、Aβ43の増加がアミロイド斑を形成する引き金になっている可能性を示すものであるという。
さらに研究グループでは、神経細胞に対する3つのAβ種の毒性を比較した。マウス胎児から調製した初代培養神経細胞に対し、それぞれ1~10μMの濃度で各Aβ種を添加した結果、Aβ42とAβ43が濃度の増加に伴い神経細胞の生存率が低下し、傷害率も上昇した。Aβ43がAβ42より強い毒性を示したが、図1のようにAβ43の量比はAβ42よりも少ないため、脳内ではAβ42、Aβ43が同様に強い神経毒性を発揮していると考えられ、このことは、これまでAβ42だけが神経毒性の本体と考えられてきたが、Aβ43も神経毒性の本体である可能性を示すものであると研究グループでは指摘している。
図4 神経細胞に対するAβ43毒性の比較。Aβ濃度の増加に伴い、Aβ43の神経細胞の生存率が顕著に減少し、傷害率が顕著に増加することから、Aβ43が最も強い毒性を示していることが示された
続けて、各Aβ種の凝集性の比較をチオフラビンTの取り込みを指標に行った結果、Aβ43が最も強い凝集性を示したほか、Aβ43は、他の2種に比べて少量でAβの凝集を促進する因子であることが明らかとなった。
図5 各Aβ種の凝集性とAβ43の凝集促進作用。左が20μMの濃度の各Aβ種に対するチオフラビンTの取り込みを解析したもの。蛍光強度が高いほど強い凝集性を示し、Aβ43が最も強い凝集性を示した。右はAβ40とAβ42がそれぞれ20μM、2μM存在している溶液中に、0.2μMの濃度の各Aβ種を添加し、チオフラビンTの取り込み強度を測定したもの。結果として、Aβ43を添加した時に顕著な凝集の促進が認められた
この凝集性の強さは、アルツハイマー病患者の脳切片の解析でも顕著に示されていた。アルツハイマー病患者のアミロイド斑を免疫組織化学的手法により可視化したところ、アミロイド斑の中心部分(図6の黄色で示される部位)にAβ43が凝集していることが明らかとなったほか、タンパク質の強力な凝集部位と特異的に結合するチオフラビンSの染色像とも重なっていることが確認された。これは、Aβ43の凝集が引き金となってアミロイド斑が、患者の脳内で形成されていることを示しているという。
図6 アルツハイマー病患者のアミロイド斑におけるAβ43の局在。Aβ全体(a)とAβ43(b)を重ね合わせる(c)とアミロイド斑の中心にAβ43が局在していた。また(d)ではタンパク質の強力な凝集部位と特異的に結合するチオフラビンSの染色像とが重なっていた
加えて研究グループでは、アルツハイマー病においてAβ43の量が何を規定しているのかを調べるために、家族性アルツハイマー病の原因遺伝子の1つであるプレセニリン1のさまざまな変異を培養細胞に遺伝子導入し、Aβ43の産生能を解析した。その結果、アルツハイマー病を早期に発症する家系の変異(I143TやG384Aなど)ほどAβ43の産生能が高いことが明らかとなり、発症年齢とAβ43の存在量や存在比に高い相関関係が認められたという。
図7 家族性アルツハイマー病の発症年齢とAβ43の相関関係。家族性アルツハイマー病の発症年齢とAβ43の存在量に高い相関関係が見られた
これまでアルツハイマー病の有力候補だと期待されていたAβ40やAβ42に対する抗体を用いたAβワクチン法が多くの臨床実験で試みられ、ことごとく失敗してきたが、その理由として、Aβ43の毒性を除去しきれていなかった可能性があり、Aβ40とAβ42を中心とした研究を見直し、Aβ43も対象にしたAβワクチン法を研究していく必要があるかもしれないと研究グループでは述べており、Aβの産生抑制を目的とした薬剤開発に関しても、Aβ40とAβ42だけでなく、Aβ43を含めた指標作りが必要となるとしており、今後、毒性本体と考えられていたAβ42だけでなく、Aβ43も含めて標的とすることで、アルツハイマー病の根本治療や予防法の開発へ発展していくことが期待されるとしている。
また、研究グループでは今回の研究において、Aβ43の脳内濃度の増加が発症年齢を規定している可能性も示した。Aβ43が加齢に伴い脳内で出現してくることからも、アルツハイマー病患者の大部分(98%以上)を占める孤発性(非遺伝性)アルツハイマー病の発症と、Aβ43の脳内出現との間にも相関関係が認められるかもしれないとしている。アルツハイマー病に直接関連した因子で、加齢性変化を示す因子はほとんど発見されておらず、Aβ43が早期診断マーカーや老化の指標となる可能性があることから、Aβ43を指標としたアルツハイマー病の早期診断法の確立が期待できるという。
